
基因治疗是将正常基因或带有治疗作用的基因通过一定方式导入人体,以纠正或补充基因缺陷及异常所带来的疾病的治疗方案。遗传病、罕见病治疗是基因治疗的重要应用方向,目前已经获批上市的基因疗法多围绕这两点展开。但由于价格高昂、监管有待完善、竞争激烈以及适应症有限,基因治疗行业在业界广泛关注的同时也伴随争议。基因疗法目前的应用包括单基因遗传病、血友病、眼科及部分神经退行性疾病,发病/治疗机制相对明确的多基因遗传病以及癌症的治疗研究。下文就治疗领域的药物临床试验进展情况进行了一定的整理和分析。
截至2019年9月,以lentivirus为载体的体外基因治疗临床试验共有115项,以rAAV为载体的体内基因治疗临床试验共有190项。以ZFN、TALEN和CRISPR-Cas技术作为基因编辑工具的临床试验共32项,大部分针对肿瘤的治疗。
在罕见病/遗传病治疗领域,有4项研究是使用rAAV作为载体的体内基因编辑试验,另外5项为体外基因编辑试验(未使用慢病毒作为基因编辑工具的递送载体)。在正在进行中的基因治疗临床试验中,约58%为Ⅱ期研究、33%为Ⅰ期研究,Ⅲ期临床试验占比大约9%。
目前正在进行的以慢病毒为载体的体外基因疗法临床试验共有55项,多数集中于X-连锁严重联合免疫缺陷、镰刀型红细胞贫血、血友病、粘多糖贮积症(MPS)以及溶酶体贮积症等遗传病的治疗。
rAAV基因递送治疗临床试验概况
在不同血清型中,研究最为充分的AAV2和AAV8最多地被用于临床试验。由于rAAV的不同血清型天然存在对于特定组织和器官的靶向性,目前大多数基于rAAV的基因治疗集中于对肝脏、横纹肌和中枢神经系统的特异性靶向。
多种天然AAV衣壳蛋白均可传输至肝脏,该载体在治疗A型血友病、B型血友病、家族性高胆固醇血症、鸟苷酸转糖化酶缺乏症和Crigler-Najjar综合症中发挥作用.
AAV8和AAV9可以针对全身多种肌肉类型,用于治疗杜氏肌营养不良(DMD),以及运用心脏中与某些信号通路和代谢相关的特定基因如SERCA2a治疗心脏衰竭等。

AAV为载体的体内基因疗法临床试验统计(截至2018年11月)(来源:Nature)
从上图可以看出,临床开发中rAAV的基因递送治疗中,很大一部分作用于中枢神经系统,包括脑以及眼球。眼球是一个相对分隔的器官,血眼屏障的存在使得rAAV病毒直接眼底注射即可达到基因递送的效果,且治疗所需病毒载体数量较少,不会导致炎症性免疫反应,减少了由于抗体中和或免疫反应引起的疗效降低。
目前针对眼部进行基因治疗临床试验的适应症包括先天性黑朦、遗传性脉络膜视网膜营养不良、全色盲和Leber遗传性视神经病变(LHON)。
相比之下,大脑更加复杂,体积相对较大,因此脑实质直接注射rAAV会导致rAAV的局部分布。
对于如帕金森症这类致病区域相对明确的神经系统疾病,核壳区域使用rAAV即为理想治疗方法。另外,鞘内注射病毒至脑脊液间隙也可获得更广泛的中枢神经分布,但相对风险较大。
AAV9和AAVrh.10可以穿越血脑屏障,因此可用其将基因传递至神经元和胶质细胞。目前已经有研究证明了全身性rAAV治疗中枢神经系统疾病的疗效,包括脊髓型肌萎缩症(SMA)、肌萎缩侧索硬化症、卡纳文病等适应症。
基因编辑临床试验汇总
由于基因编辑技术本身较新,机制并非完全揭示,脱靶效应并非完全可控,出于安全性的考虑,即便在科研领域引起了极大的关注和广泛的研究,基因编辑技术真正在临床当中应用仍然相对有限。
截至目前,在临床试验中可查的三种基因编辑技术分别为ZFN (14项),TALEN( 3项),CRISPR (15项),其中ZFN的大部分临床试验针对HIV感染(8项试验,CCR5作为靶点),TALEN和CRISPR的大部分临床试验集中在多种癌症的治疗领域(13项),并且中国的临床试验总数在全球名列前茅。
在罕见病/遗传病治疗领域方面,ZFN的5项试验全部被Sangamo公司囊括,适应症包括B型血友病、MPS以及地中海贫血和镰状细胞病(与Bioverativ赛诺菲子公司合作进行)。
CRISPR-Cas9相关试验共四项,3项为针对血液疾病的体外治疗,其唯一的体内治疗研究针对先天性黑朦。
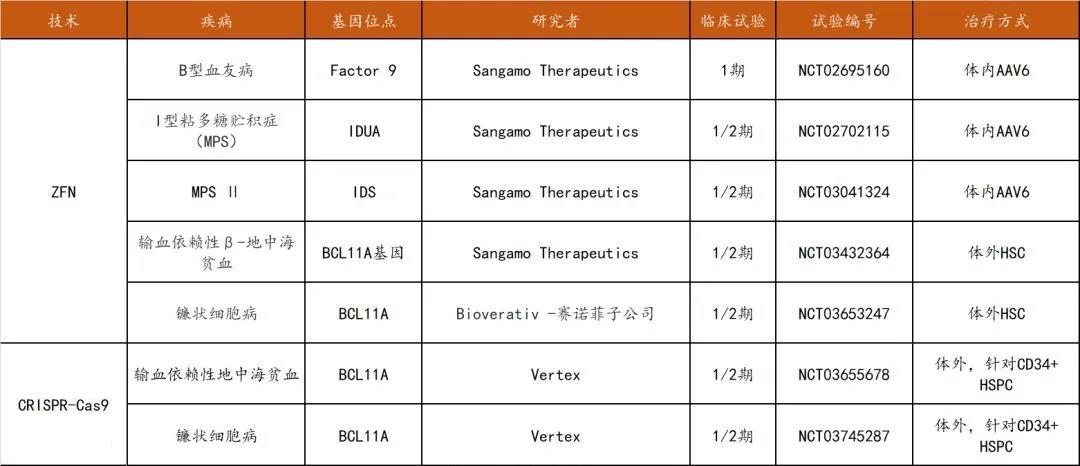
数据来源:clinicaltrials.gov,探针资本
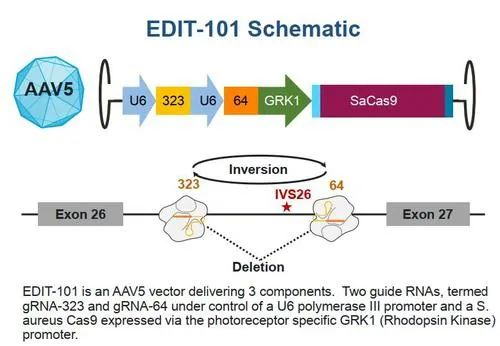
首例CRISPR体内基因编辑药物治疗原理(来源:Editas官网)
Address: No. 96 Tanghuai Road, Xiaodian District, Taiyuan City, Shanxi Province
Tel: 18635123668 (product sales)
18734150104 (ELISA technical support)
15271473496 (qPCR technical support)
Email: junyans21@163.com